Καρκίνος Ουροδόχου Κύστης
Καρκίνος Ουροδόχου Κύστης
ΚΑΡΚΙΝΟΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ – ΕΠΙΔΗΜΙΟΛΟΓΙΑ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΗΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ
Ο καρκίνος της ουροδόχου κύστης είναι ο πρώτος σε συχνότητα καρκίνος του ουροποιητικού συστήματος, αντιπροσωπεύοντας το 4,5% των κακοηθειών (6% στους άνδρες και 3% στις γυναίκες) και το 1,9% των θανάτων από καρκίνο. Στις ΗΠΑ αποτελεί την τέταρτη πιο συχνή μορφή καρκίνου στους άνδρες και την ένατη στις γυναίκες, με ετήσια επίπτωση 18/100.000, οδηγώντας περίπου σε 12.000 θανάτους ετησίως. Σε παγκόσμιο επίπεδο, η θνητότητα κυμαίνεται από 2 έως 10 ανά 100.000 ανά έτος στους άνδρες και 0,5 έως 4 ανά 100.000 ανά έτος στις γυναίκες.
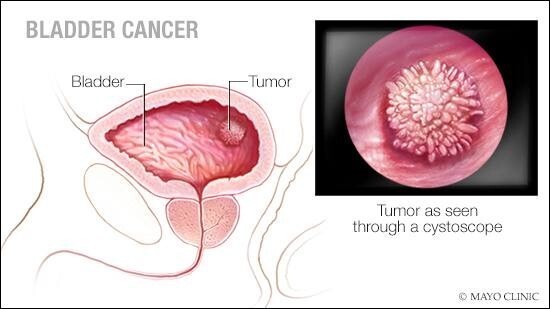
O κίνδυνος ανάπτυξης καρκινώματος ουροδόχου κύστης σε ηλικία < των 75 ετών είναι 2% – 4% στους άνδρες και 0,5% – 1% στις γυναίκες. Η σχέση της συχνότητας εμφάνισης μεταξύ ανδρών και γυναικών είναι περίπου 3:1 με αυξητική τάση στις γυναίκες, με πιθανότητα η επιβίωση ανάλογα με το στάδιο να είναι χειρότερη απ΄ό,τι στους άνδρες, ενώ από φυλετικής πλευράς η συχνότητα εμφάνισης είναι διπλάσια στους λευκούς σε σχέση με τους μαύρους. Η επιβίωση όμως στους Αφροαμερικανούς φαίνεται να είναι χειρότερη απ΄ότι στους Λευκούς Αμερικανούς. Ενώ οι 2 ομάδες έχουν παρόμοιο κίνδυνο για περισσότερο διηθητικούς όγκους, οι Ευρωπαίοι Αμερικανοί παρουσιάζουν υψηλότερη επίπτωση για επιφανειακά καρκινώματα. Το μεγαλύτερο ποσοστό (περίπου 80%) των περιπτώσεων καρκίνου της κύστης απαντάται μεταξύ 50 και 79 ετών και η μέση ηλικία διάγνωσης είναι τα 65 χρόνια.
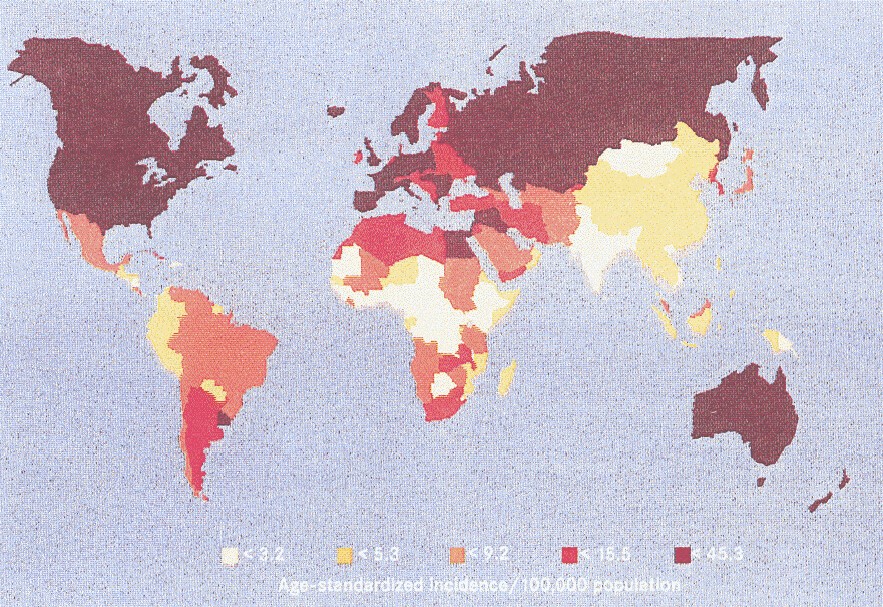
Η παγκόσμια επίπτωση του καρκίνου της ουροδόχου κύστης στον ανδρικό πληθυσμό. Αν και η πλειονότητα των περιπτώσεων παρατηρείται στις ανεπτυγμένες περιοχές, ο καρκίνος της ουροδόχου κύστης εμφανίζει υψηλούς ρυθμούς σε ορισμένες αναπτυσσόμενες περιοχές, περιλαμβάνοντας μέρη της Β.Αφρικής και της Ν.Αμερικής.
ΚΑΡΚΙΝΟΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ – ΑΙΤΙΟΛΟΓΙΚΟΙ ΠΑΡΑΓΟΝΤΕΣ
- Κάπνισμα
- Νιτροζαμίνες
- Βενζιδίνη
- Ναφθυλαμίνη
- Χλωριωμένοι αλειφατικοί Η/C
- Αρυλαμίνες
- Νιτροζαμίνες
- Αλλοι
- Φάρμακα
- Φαινακετίνη
- Ακτινοβολία
- Λοιμογόνοι παράγοντες
- S.haematobium
Ο βλεννογόνος της ουροδόχου κύστης έρχεται σε επαφή με όλες σχεδόν τις προσλαμβανόμενες ουσίες ή τους μεταβολίτες τους, κατά την είσοδό τους στον οργανισμό (και μεταξύ αυτών και οι νιτροδοενώσεις). Πιστεύεται ότι ο κρίσιμος στόχος των χημικών καρκινογόνων είναι το γενετικό υλικό. Η χημική αλλοίωση που προκαλούν τα καρκινογόνα στο γενετικό υλικό των κυττάρων-στόχων, θεωρείται το πρώτο βήμα στη διαδικασία της καρκινογένεσης της κύστης.
ΚΑΡΚΙΝΟΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ – ΚΛΙΝΙΚΗ ΠΡΟΣΕΓΓΙΣΗ
Συμπτώματα. Η ανώδυνη μακροσκοπική αιματουρία αποτελεί το πρώτο σύμπτωμα που παρουσιάζεται, περίπου σε ποσοστό 85-90% (Ozen και συν, 2000). Η αιματουρία μπορεί να είναι και μικροσκοπική, διαλείπουσα ή συνεχής και να συνυπάρχουν δυσουρικά ενοχλήματα, συχνουρία και επιτακτική ούρηση (Ozen και συν, 2000). Η επέκταση του καρκίνου της κύστης μπορεί να οδηγήσει σε αποφρακτική νεφρική ανεπάρκεια, αλλά και σε συμπτώματα από διήθηση παρακείμενων σπλάγχνων ή από μεταστάσεις.
Η διάγνωση του όγκου της ουροδόχου κύστης στηρίζεται σε συνδυασμό επεμβατικών και μη επεμβατικών μεθόδων.
Μη Επεμβατικές μέθοδοι:
– η λήψη του ιστορικού,
– η κλινική εξέταση,
– η αμφίχειρη υπό αναισθησία εξέταση της κύστης,
– η κυτταρολογική εξέταση ούρων και εκπλυμάτων κύστης
Η κυτταρολογική εξέταση των ούρων καθιερώθηκε στη διάγνωση του καρκίνου του ουροθηλίου μετά την πρώτη αναφορά των Παπανικολάου και Marshall το 1945. Ηεξέταση αυτή είναι χρήσιμη για τη διάγνωση και την πρόγνωση του καρκίνου της κύστης (ιδίως υψηλού βαθού κακοήθειας), με βασικό μειονέκτημα τη συνολικά μικρή ευαισθησία, τα υποκειμενικά διαγνωστικά κριτήρια. Τρία πρωινά δείγματα ούρων αποτελούν το καταλληλότερο υλικό για την εξέταση αυτή, με συνολική διαγνωστική ακρίβεια περίπου το 87%.
Σε ψευδώς θετικά αποτελέσματα μπορεί να οδηγήσουν:
α) Λιθίαση και επεμβατικοί χειρισμοί, όπως ο καθετηριασμός της κύστης, η κυστεοσκόπηση.
β) Χημειοθεραπεία
γ) Φλεγμονή (π.χ., διάμεση κυστίτιδα, ουρολοιμώξεις, ΗΡV), ακτινοθεραπεία στην περιοχή της πυέλου κλπ.
– οι διάφορες απεικονιστικές μέθοδοι (υπερηχογράφημα, απλή ακτινογραφία, αξονική τομογραφία, μαγνητική τομογραφία)
Υπερηχογράφημα. To υπερηχογράφημα θεωρείται εξέταση εκλογής για τη διερεύνηση μακροσκοπικής αιματουρίας, αλλά όχι για τη σταδιοποίηση του όγκου της κύστης λόγω της μειωμένης ικανότητας να εκτιμήσει την περικυστική διήθηση.
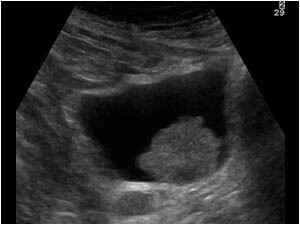
Αξονική και Μαγνητική τομογραφία. H αξονική και μαγνητική τομογραφία είναι χρήσιμες για τη σταδιοποίηση λόγω της απεικόνισης του περικυστικού χώρου, αλλά η διαγνωστική ακρίβεια είναι κυμαινόμενη, από 40-98%. Η μαγνητική τομογραφία είναι ελαφρώς πιο ευαίσθητη από την αξονική, ειδικά πρόσφατα η νέα πολυπαραμετρική μαγνητική ουροδόχου κύστης. Όταν η απεικόνιση της πυέλου γίνει μετά από διουρηθρική εκτομή του όγκου, η διαγνωστική ακρίβεια ελαττώνεται στο 32-55%, επειδή η μετεγχειρητική φλεγμονή μιμείται την παρουσία της νεοπλασματικής διήθησης. Συμπερασματικά θα λέγαμε ότι η μαγνητική και αξονική τομογραφία δεν είναι αρκετά ακριβείς για τη σταδιοποίηση του αρχικού όγκου (ειδικά μετά τη διουρηθρική), αλλά χρησιμοποιούνται για την εξακρίβωση της παρουσίας μεταστάσεων.
Επεμβατικές μέθοδοι:
– η κυστεοσκόπηση και η λήψη βιοψιών,
– η διουρηθρική εκτομή του όγκου
- Κυστεοσκόπηση
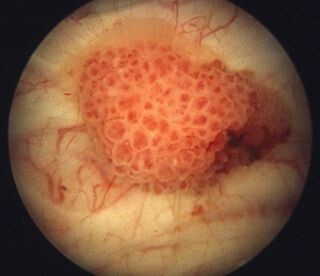
Η κυστεοσκόπηση (με άκαμπτο ή εύκαμπτο κυστεοσκόπιο), είναι η εξέταση εκλογής που θα θέσει την τελική διάγνωση σε συνδυασμό με τη βιοψία που λαμβάνεται. Με τη λήψη βιοψιών τόσο από τον όγκο, όσο και από τις γύρω από αυτόν περιοχές, επιτυγχάνεται η διάγνωση του ιστολογικού τύπου και βαθμού διαφοροποίησης του όγκου, καθώς και ο έλεγχος για την πιθανότητα συνύπαρξης άλλων (προ)καρκινικών βλαβών (CIS).
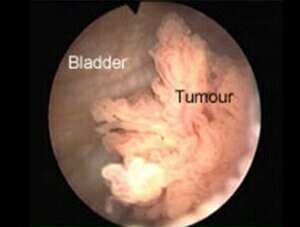
Η κυστεοσκόπηση δίνει τη δυνατότητα να εξετασθούν πολλοί από τους χαρακτήρες των όγκων, όπως η μακροσκοπική τους εικόνα (μισχωτή, άμισχη, οζώδης), το μέγεθος, ο αριθμός, η θέση, η συνύπαρξη φλεγμονής και επιτρέπει παράλληλα την εκτίμηση των ουρητηρικών στομίων.
Διουρηθρική εκτομή του όγκου
Η διουρηθρική εκτομή του όγκου (TURT: transurethral resection of the tumor) της κύστης και στη συνέχεια η ιστολογική εξέταση του παρασκευάσματος καθορίζει τελικά τον ιστολογικό βαθμό και στάδιο Τ του όγκου, ενώ παράλληλα οι τυχαίες βιοψίες προσδιορίζουν το διάχυτο ή μη της νεοπλασματικής βλάβης. Τονίζεται ότι το ενδεχόμενο υπολειμματικού όγκου μετά την διουρηθρική παραμένει υψηλό. Μελέτη αναφέρει πως υπολειμματικός καρκίνος ανευρέθη σε ποσοστό 33% στην επαναληπτική διουρηθρική.
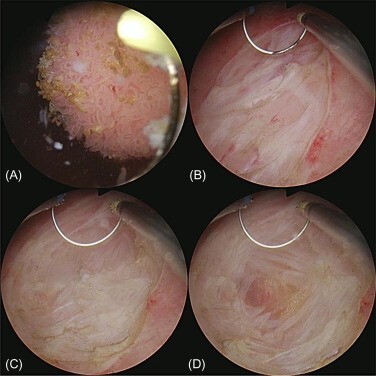
Επίσης, ο κυστεοσκοπικός φθορισμός μπορεί να βοηθήσει στην αναγνώριση των όγκων της κύστης, που δεν αναγνωρίζονται με πηγές λευκού φωτός.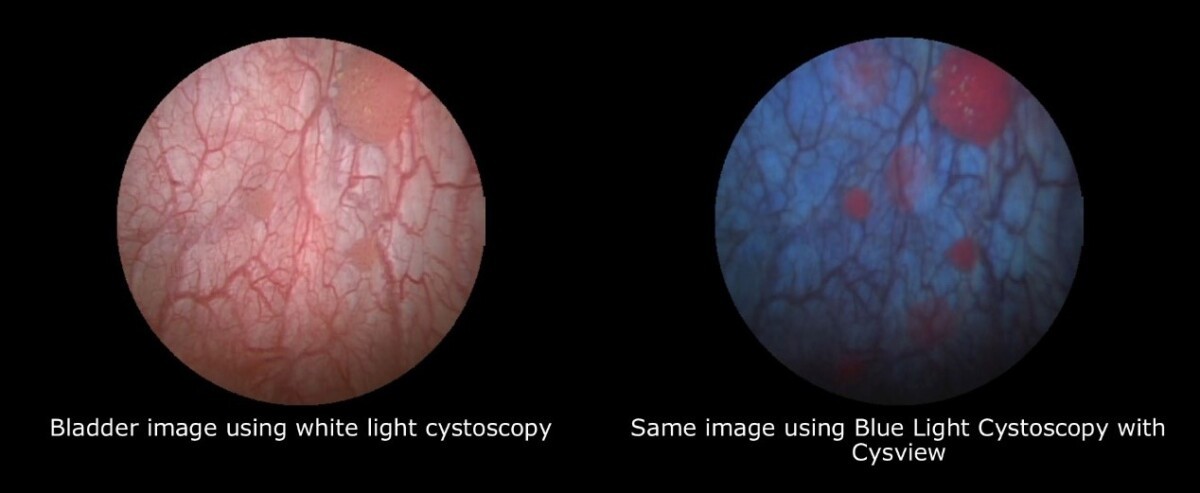
Συνήθως, μια λάμπα ξένου χρησιμοποιείται για να εντοπίσει το φθορισμό του επαγωγικού φωτός της φωτοευαίσθητης πρωτοπορφυρίνης ΙΧ, που προκαλείται μετά από τοπική εφαρμογή 5-αμινολεβουλινικού οξέος. Η ευαισθησία αυτής της μεθόδου μπορεί να φθάσει το 96%.
Η σειρά που ακολουθείται συνήθως για την διάγνωση του καρκίνου της κύστης είναι: λήψη του ιστορικού, κλινική εξέταση, υπερηχογράφημα κύστης, κυστεοσκόπηση και λήψη βιοψιών, αξονική ή μαγνητική τομογραφία αν καρκίνος διηθητικός.
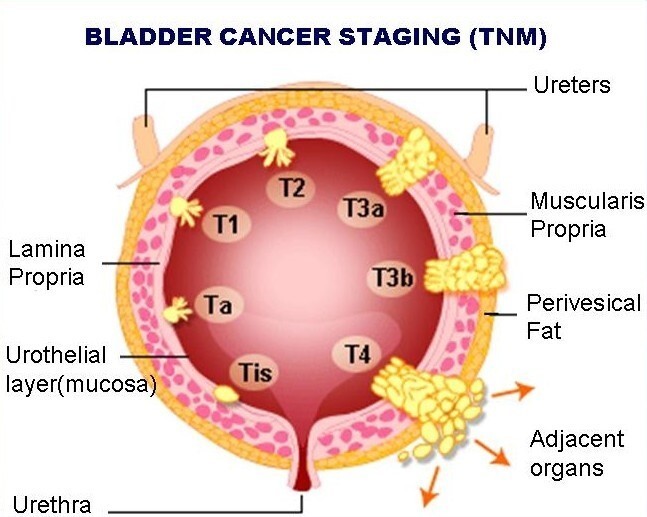
Από την στιγμή που θα τεθεί ιστολογικά η διάγνωση ‘καρκίνος ουροδόχου κύστης’ το επόμενο βήμα είναι η παθολογοανατομική και κλινική σταδιοποίηση της νόσου. Τα συστήματα παθολογοανατομικής και κλινικής σταδιοποίησης που κυρίως εφαρμόζονται σήμερα είναι το σύστημα Marchall (1952) (το οποίο αποτελεί τροποποίηση του συστήματος των Jewett και Strong (1946)) και το σύστημα TNM (Tumour, Nodes, Metastasis) που έχει προταθεί (1974) από την Διεθνή Ένωση εναντίον του καρκίνου (International Union Against Cancer, UICC), τροποποιήθηκε το 1989 και επαναδιατυπώθηκε το 1997.
ΤΑΞΙΝΟΜΗΣΗ ΚΑΡΚΙΝΟΥ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ ΜΕ ΔΙΑΦΟΡΕΤΙΚΟ ΘΕΡΑΠΕΥΤΙΚΟ ΚΑΙ ΠΡΟΓΝΩΣΤΙΚΟ ΕΝΔΙΑΦΕΡΟΝ
ΕΠΙΦΑΝΕΙΑΚΟΙ ΟΓΚΟΙ (Τα λεγόμενα θηλώματα):
- pTa βλάβη μόνο στο πρώτο στρώμα, που λέγεται βλεννογόνος
- pT1 βλάβη και στο 2ο στρώμα που λέγεται χόριο (περιλαμβάνει και την υποβλεννογόνια μυϊκή στιβάδα)
Σε αυτές τις 2 κατηγορίες θηλωμάτων παίζει ρόλο και ο βαθμός επιθετικότητας των κυττάρων (χαμηλός ή υψηλός βαθμός κακοήθειας)
Mέχρι σήμερα, το 2022, κανένας παράγοντας (βιταμίνες ή άλλα στοιχεία) δεν μπορεί να προταθεί ως προστατευτικός για την αποφυγή του καρκίνου της ουροδόχου κύστης με αποτέλεσμα να μην έχει ακόμη καθοριστεί η στρατηγική της πρόληψής του πέρα από την αποφυγή του καπνίσματος. Για τη θεραπεία των επιφανειακών όγκων της ουροδόχου κύστης απαιτείται ολοκληρωτική αφαίρεση του όγκου και εκτίμηση για περαιτέρω συμπληρωματική θεραπεία και παρακολούθηση του ασθενούς. Θεραπεία εκλογής είναι η διουρηθρική αφαίρεση TURT με ρεζεκτοσκόπια που διαθέτουν ηλεκτρική αγκύλη κοπής και επικρατέστερα με διπολικό ρεύμα turis, ή λιγότερο συχνά με laser (Nd: YAG, Holmium: YAG, CO2, KTP) που προκαλούν θερμική τήξη και εξάχνωση (Herr και συν, 2001). Τα laser έχουν ως πλεονέκτημα τα χαμηλά ποσοστά επιπλοκών (π.χ., αιμορραγία, διάτρηση, ερεθιστικά συμπτώματα), ενώ βασικό μειονέκτημα είναι η αδυναμία συλλογής υλικού για βιοψία. Η TURT πραγματοποιείται υπό συνεχή ενδοκυστική ροή διαλυμάτων (αποστειρωμένου νερού ή αμινοξέων) και απαιτείται στο υλικό βιοψίας να περιέχονται και μυϊκές ίνες για τον καθορισμό του σταδίου του όγκου. Έτσι, η TURT αποτελεί τη θεραπεία εκλογής αλλά και σταδιοποίησης της νόσου. Πιθανές επιπλοκές της TURT είναι η αιμορραγία, η διάτρηση της κύστης, η κυστεοουρητηρική παλινδρόμηση και τα στενώματα της ουρήθρας (πολύ μικρά ποσοστά σε έμπειρα χέρια).
Πολλοί ασθενείς υποβάλλονται σε επανάληψη της TURT λόγω υποτροπής του καρκίνου της κύστης. Οι ασθενείς που παραμένουν χωρίς υποτροπή κατά τη διάρκεια του πρώτου έτους παρακολούθησης, είναι πιθανό να μην υποτροπιάσουν για μερικά χρόνια, ενώ εκείνοι που παρουσιάζουν υποτροπή κατά το πρώτο έτος (που είναι και οι περισσότεροι) έχουν υψηλό κίνδυνο να υποτροπιάσουν στο μέλλον. Υποστηρίζεται ότι το 50% των όγκων σταδίου Τα και το 70% των όγκων σταδίου Τ1 υποτροπιάζουν στα 3 χρόνια μετά την TURT.
Η υψηλή συχνότητα των υποτροπών αποδίδεται πρωταρχικά στον πολυεστιακό χαρακτήρα της νόσου, αν και η εμφύτευση καρκινικών κυττάρων κατά την TURT θεωρείται ως ένας επιπρόσθετος προδιαθεσικός παράγοντας. Υποστηρίζεται ότι οι περισσότερες υποτροπές αποτελούν νέους όγκους προερχόμενους από δυσπλαστικές βλάβες, η από μη ορατές ενδοσκοπικά νεοπλασίες. Επίσης, μία σημαντική αιτία υποτροπής είναι η μη πλήρης εκτομή του όγκου στην πρώτη TURT. Η υποτροπή στους 3 μήνες οφείλεται κυρίως σε ανεπαρκή TURT ή/και σε εμφύτευση καρκινικών κυττάρων σε τραυματισμένα σημεία ή/και σε ταχεία καρκινική ανάπτυξη, γι’ αυτό σε υψηλού βαθμού κακοήθειας όγκους συνίσταται και 2η TURT εντός τριών βδομάδων από την 1η TURT. Πρόσφατα, διαπιστώθηκε ότι η πραγματοποίηση μιας δεύτερης TURT, 4-6 εβδομάδες μετά την πρώτη, ανέδειξε υπολειπόμενο όγκο στο 20% των ασθενών, που ήταν υψηλότερου ιστολογικού βαθμού σε ποσοστό 8,2%, ενώ άλλες μελέτες ανεβάζουν το ποσοστό υποτροπής στο 38%, ακόμα και μέχρι 80%. Επιπλέον, στο 75% των όγκων Τα και στο 85% των όγκων Τ1, η υποτροπή εντοπίστηκε στην περιοχή του όγκου που εξαιρέθηκε.
Θεραπεία των θηλωμάτων
Απόλυτη και αυστηρή πλήρης διουρηθρική (μέσα από την ουρήθρα) αφαίρεση.
Άμεση το 1ο 24ωρο έγχυση ενός κυτταροστατικού φαρμάκου στην κύστη (συνηθέστερη η επιρουμπικίνη)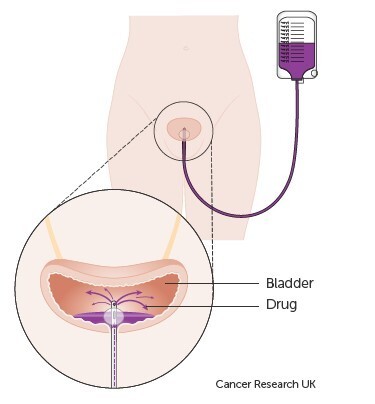
Ανάλογα με το αν είναι pTa ή pT1 και επίσης ανάλογα με το αν πρόκειται για χαμηλού ή υψηλού βαθμού κακοήθειας όγκους, προτείνεται σχήμα ενδοκυστικών εγχύσεων με κυτταροστατικά φάρμακα ή το BCG (εξασθενημένο μυκοβακτηρίδιο της φυματίωσης).
Παρακολούθηση των ασθενών με θηλώματα
Η παρακολούθηση των ασθενών με επιφανειακούς όγκους της κύστης πρέπει να γίνεται σ’ όλη τη διάρκεια της ζωής τους, με κυστεοσκόπηση και κυτταρολογική εξέταση. Πρόσφατη βιβλιογραφική ανασκόπηση αναφέρει ότι οι προαναφερόμενες εξετάσεις στα ούρα έχουν ειδικότητα 73-90%, ευαισθησία 49-77% και η χρήση τους για την παρακολούθηση μπορεί να αυξήσει τα μεσοδιαστήματα των κυστεοσκοπήσεων ελέγχου. Η συχνότητα της παρακολούθησης δεν είναι απαραίτητο να είναι ίδια σε όλους τους ασθενείς, αλλά πρέπει να πραγματοποιείται ανά τακτά χρονικά διαστήματα και να εξατομικεύεται, συσχετιζόμενη με τους προγνωστικούς παράγοντες.
ΔΙΗΘΗΤΙΚΟΣ ΚΑΡΚΙΝΟΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ
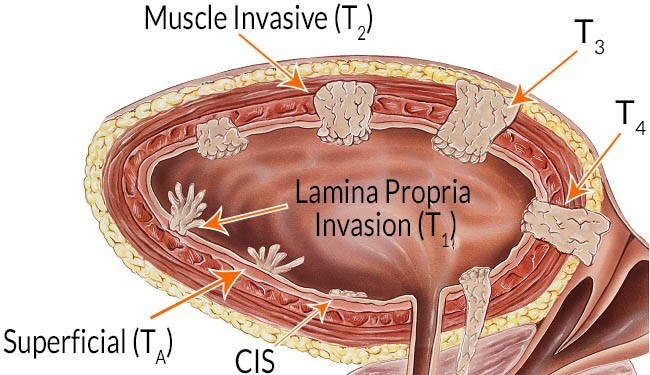
Αν στην αρχική διουρηθρική αφαίρεση του όγκου κύστης η ιστολογική διάγνωση αναδείξει διηθητικό καρκίνωμα (διήθηση μυός της κύστης), η αντιμετώπιση είναι διαφορετική, πιο επιθετική και η πρόγνωση πιο πτωχή.
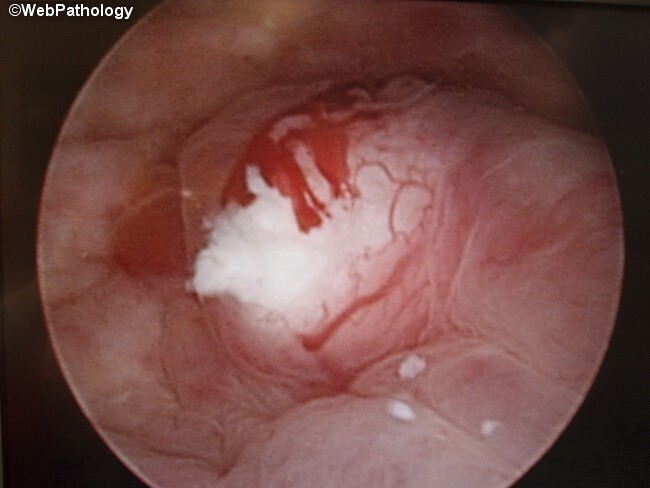
Η κλασική θεραπεία για τον τοπικά περιορισμένο διηθητικό καρκίνο της ουροδόχου κύστης αποτελεί η ριζική κυστεκτομή και ο πυελικός λεμφαδενικός καθαρισμός. Αυτή η θεραπευτική προσέγγιση απαλάσσει συχνά τον ασθενή από τη νόσο, όταν αυτή περιορίζεται μέσα στο όργανο και δεν υπάρχει επινέμηση των λεμφαδένων. Στον άνδρα η κύστη αφαιρείται μαζί με τον προστάτη και στη γυναίκα συνήθως μαζί με τη μήτρα και ωοθήκες. Και στα 2 φύλα περιλαμβάνεται και η εκτεταμένη ταυτόχρονη εξαίρεση των λεμφαδένων της πυέλου (λεκάνης). Αποτελέσματά από 1054 ασθενείς με ριζική κυστεκτομή ανέφεραν ποσοστά δεκαετούς ελεύθερης νόσου και συνολικής επιβίωσης 66% και 43% για όλους τους ασθενείς, αντίστοιχα. Η επίπτωση υποτροπών της νόσου σχετίζεται με το φύλο, το παθολογοανατομικό στάδιο, τη λεμφαδενική μετάσταση, τη λεμφαδενική διήθηση, όπως και την αγγειακή διήθηση. Η παρουσία θετικών λεμφαδένων αποδείχτηκε ένας ιδιαίτερα πτωχός προγνωστικός παράγοντας, με ποσοστά δεκαετούς ελεύθερης νόσου επιβίωσης 75% για όλους τους ασθενείς με αρνητικούς λεμφαδένες σε σύγκριση με μόλις 34% σε ασθενείς με λεμφαδενική διασπορά. Σημαντικό να αναφερθεί πως πριν την κυστεκτομή απαράιτητα θα πρέπει να λάβουν χώρα 2-3 κύκλοι χημειοθεραπείας, ώστε να επιτευχθεί συρρίκνωση του όγκου, κάτι που βελτιώνει την πρόγνωση μετά το χειρουργείο.
Η επιβίωση μετά την κυστεκτομή έχει συσχετιστεί με τον αριθμό των εξεταζόμενων λεμφαδένων, όπως επίσης και με τον αριθμό των θετικών λεμφαδένων, υποθέτοντας ότι η ποιότητα και η έκταση της λεμφαδενεκτομής είναι υψηλού ενδιαφέροντος και έχει επίπτωση στο θεραπευτικό αποτέλεσμα. Αυτή η άποψη οδήγησε στην ιδέα της λεμφαδενικής πυκνότητας, ή της αναλογίας (ratio) (αριθμός θετικών λεμφαδένων προς τον ολικό αριθμό των αφαιρεθέντων λεμφαδένων). Πρόσφατες μελέτες έδειξαν ότι η επιβίωση βελτιώνεται σημαντικά όταν λιγότεροι από 20% των λεμφαδένων είναι θετικοί. Το συμπέρασμα αυτό μπορεί να αποδειχθεί χρήσιμο στην περαιτέρω εντόπιση ασθενών με υψηλό κίνδυνο για υποτροπή. Η ανάγκη για εκτεταμένη λεμφαδενεκτομή στον καρκίνο της ουροδόχου κύστης είναι επιτακτική και προφανής.
Είναι αλήθεια πως ογκολογικά η ανοικτή κυστεκτομή έχει τα ίδια καλά αποτελέσματα με τη ρομποτική. Η τελευταία όμως λόγω της ελάχιστης παρέμβασης υπερτερεί στην απώλεια αίματος, στη μείωση του εγχειρητικού τραύματος, στην κατάχρηση των αναλγητικών, στην κινητοποίηση των ασθενών και έξοδο από το νοσοκομείο, όπως και στην πιθανότητα μετεγχειρητικών κηλών λόγω έλλειψης τομής. Επίσης, η ρομποτική με περίσσεια ακρίβειας και πολύ πιο περιορισμένων χειρισμών αποκαθιστά την εκτροπή των ούρων με δημιουργία νέας κύστης από έντερο.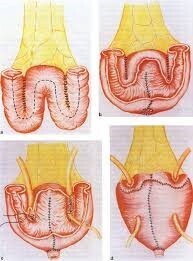
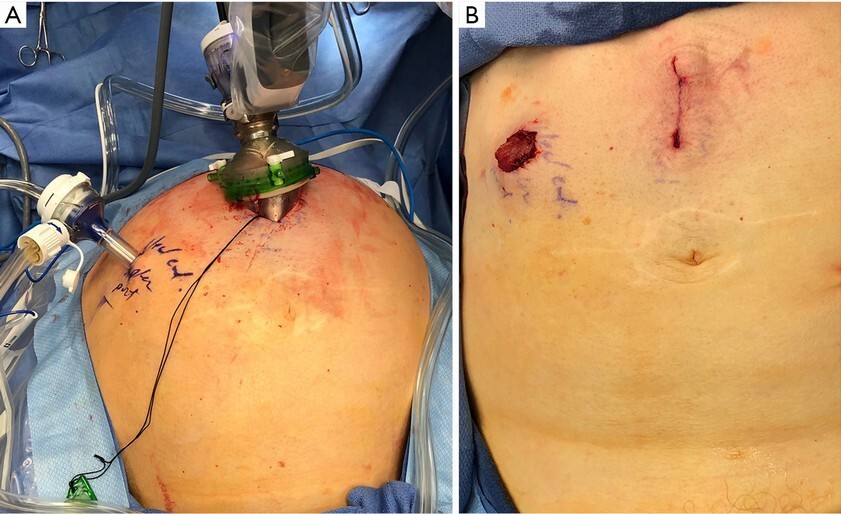
Εδώ και πολλά χρόνια στο Κέντρο Ελάχιστα Επεμβατικής Ουρολογίας, έχουν πραγματοποιηθεί πληθώρα ρομποτικών ριζικών κυστεκτομών με εκτροπή ούρων με εξαιρετικά και ογκολογικά αλλά και λειτουργικά αποτελέσματα (εγκράτεια και ακόμα διατήρηση στυτικής λειτουργίας στους άνδρες). Επειδή θεωρείται δε κέντρο αναφοράς, έχουν πραγματοποιηθεί και κυστεκτομές διάσωσης μετά από αποτυχημένη ακτινοθεραπεία, εξαιρετικά δύσκολη επέμβαση λόγω των ινώσεων που προκαλεί η ακτινοβολία.
Αν ο ασθενής δεν είναι υποψήφιος για ριζική κυστεκτομή λόγω άλλης νοσηρότητας ή προχωρημένης ηλικίας, τότε ακολουθείται συνδυασμός ακτινοθεραπείας μαζί με χημειοθεραπεία, αλλά με πτωχότερα αποτελέσματα αναφορικά στην πρόγνωση.
ΑΛΛΕΣ ΠΑΘΗΣΕΙΣ
Καρκίνος Ουροδόχου Κύστης
ΚΑΡΚΙΝΟΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ – ΕΠΙΔΗΜΙΟΛΟΓΙΑ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΗΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ
Ο καρκίνος της ουροδόχου κύστης είναι ο πρώτος σε συχνότητα καρκίνος του ουροποιητικού συστήματος, αντιπροσωπεύοντας το 4,5% των κακοηθειών (6% στους άνδρες και 3% στις γυναίκες) και το 1,9% των θανάτων από καρκίνο. Στις ΗΠΑ αποτελεί την τέταρτη πιο συχνή μορφή καρκίνου στους άνδρες και την ένατη στις γυναίκες, με ετήσια επίπτωση 18/100.000, οδηγώντας περίπου σε 12.000 θανάτους ετησίως. Σε παγκόσμιο επίπεδο, η θνητότητα κυμαίνεται από 2 έως 10 ανά 100.000 ανά έτος στους άνδρες και 0,5 έως 4 ανά 100.000 ανά έτος στις γυναίκες.

O κίνδυνος ανάπτυξης καρκινώματος ουροδόχου κύστης σε ηλικία < των 75 ετών είναι 2% – 4% στους άνδρες και 0,5% – 1% στις γυναίκες. Η σχέση της συχνότητας εμφάνισης μεταξύ ανδρών και γυναικών είναι περίπου 3:1 με αυξητική τάση στις γυναίκες, με πιθανότητα η επιβίωση ανάλογα με το στάδιο να είναι χειρότερη απ΄ό,τι στους άνδρες, ενώ από φυλετικής πλευράς η συχνότητα εμφάνισης είναι διπλάσια στους λευκούς σε σχέση με τους μαύρους. Η επιβίωση όμως στους Αφροαμερικανούς φαίνεται να είναι χειρότερη απ΄ότι στους Λευκούς Αμερικανούς. Ενώ οι 2 ομάδες έχουν παρόμοιο κίνδυνο για περισσότερο διηθητικούς όγκους, οι Ευρωπαίοι Αμερικανοί παρουσιάζουν υψηλότερη επίπτωση για επιφανειακά καρκινώματα. Το μεγαλύτερο ποσοστό (περίπου 80%) των περιπτώσεων καρκίνου της κύστης απαντάται μεταξύ 50 και 79 ετών και η μέση ηλικία διάγνωσης είναι τα 65 χρόνια.

Η παγκόσμια επίπτωση του καρκίνου της ουροδόχου κύστης στον ανδρικό πληθυσμό. Αν και η πλειονότητα των περιπτώσεων παρατηρείται στις ανεπτυγμένες περιοχές, ο καρκίνος της ουροδόχου κύστης εμφανίζει υψηλούς ρυθμούς σε ορισμένες αναπτυσσόμενες περιοχές, περιλαμβάνοντας μέρη της Β.Αφρικής και της Ν.Αμερικής.
ΚΑΡΚΙΝΟΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ – ΑΙΤΙΟΛΟΓΙΚΟΙ ΠΑΡΑΓΟΝΤΕΣ
- Κάπνισμα
- Νιτροζαμίνες
- Βενζιδίνη
- Ναφθυλαμίνη
- Χλωριωμένοι αλειφατικοί Η/C
- Αρυλαμίνες
- Νιτροζαμίνες
- Αλλοι
- Φάρμακα
- Φαινακετίνη
- Ακτινοβολία
- Λοιμογόνοι παράγοντες
- S.haematobium
Ο βλεννογόνος της ουροδόχου κύστης έρχεται σε επαφή με όλες σχεδόν τις προσλαμβανόμενες ουσίες ή τους μεταβολίτες τους, κατά την είσοδό τους στον οργανισμό (και μεταξύ αυτών και οι νιτροδοενώσεις). Πιστεύεται ότι ο κρίσιμος στόχος των χημικών καρκινογόνων είναι το γενετικό υλικό. Η χημική αλλοίωση που προκαλούν τα καρκινογόνα στο γενετικό υλικό των κυττάρων-στόχων, θεωρείται το πρώτο βήμα στη διαδικασία της καρκινογένεσης της κύστης.
ΚΑΡΚΙΝΟΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ – ΚΛΙΝΙΚΗ ΠΡΟΣΕΓΓΙΣΗ
Συμπτώματα. Η ανώδυνη μακροσκοπική αιματουρία αποτελεί το πρώτο σύμπτωμα που παρουσιάζεται, περίπου σε ποσοστό 85-90% (Ozen και συν, 2000). Η αιματουρία μπορεί να είναι και μικροσκοπική, διαλείπουσα ή συνεχής και να συνυπάρχουν δυσουρικά ενοχλήματα, συχνουρία και επιτακτική ούρηση (Ozen και συν, 2000). Η επέκταση του καρκίνου της κύστης μπορεί να οδηγήσει σε αποφρακτική νεφρική ανεπάρκεια, αλλά και σε συμπτώματα από διήθηση παρακείμενων σπλάγχνων ή από μεταστάσεις.
Η διάγνωση του όγκου της ουροδόχου κύστης στηρίζεται σε συνδυασμό επεμβατικών και μη επεμβατικών μεθόδων.
Μη Επεμβατικές μέθοδοι:
– η λήψη του ιστορικού,
– η κλινική εξέταση,
– η αμφίχειρη υπό αναισθησία εξέταση της κύστης,
– η κυτταρολογική εξέταση ούρων και εκπλυμάτων κύστης
Η κυτταρολογική εξέταση των ούρων καθιερώθηκε στη διάγνωση του καρκίνου του ουροθηλίου μετά την πρώτη αναφορά των Παπανικολάου και Marshall το 1945. Ηεξέταση αυτή είναι χρήσιμη για τη διάγνωση και την πρόγνωση του καρκίνου της κύστης (ιδίως υψηλού βαθού κακοήθειας), με βασικό μειονέκτημα τη συνολικά μικρή ευαισθησία, τα υποκειμενικά διαγνωστικά κριτήρια. Τρία πρωινά δείγματα ούρων αποτελούν το καταλληλότερο υλικό για την εξέταση αυτή, με συνολική διαγνωστική ακρίβεια περίπου το 87%.
Σε ψευδώς θετικά αποτελέσματα μπορεί να οδηγήσουν:
α) Λιθίαση και επεμβατικοί χειρισμοί, όπως ο καθετηριασμός της κύστης, η κυστεοσκόπηση.
β) Χημειοθεραπεία
γ) Φλεγμονή (π.χ., διάμεση κυστίτιδα, ουρολοιμώξεις, ΗΡV), ακτινοθεραπεία στην περιοχή της πυέλου κλπ.
– οι διάφορες απεικονιστικές μέθοδοι (υπερηχογράφημα, απλή ακτινογραφία, αξονική τομογραφία, μαγνητική τομογραφία)
Υπερηχογράφημα. To υπερηχογράφημα θεωρείται εξέταση εκλογής για τη διερεύνηση μακροσκοπικής αιματουρίας, αλλά όχι για τη σταδιοποίηση του όγκου της κύστης λόγω της μειωμένης ικανότητας να εκτιμήσει την περικυστική διήθηση.

Αξονική και Μαγνητική τομογραφία. H αξονική και μαγνητική τομογραφία είναι χρήσιμες για τη σταδιοποίηση λόγω της απεικόνισης του περικυστικού χώρου, αλλά η διαγνωστική ακρίβεια είναι κυμαινόμενη, από 40-98%. Η μαγνητική τομογραφία είναι ελαφρώς πιο ευαίσθητη από την αξονική, ειδικά πρόσφατα η νέα πολυπαραμετρική μαγνητική ουροδόχου κύστης. Όταν η απεικόνιση της πυέλου γίνει μετά από διουρηθρική εκτομή του όγκου, η διαγνωστική ακρίβεια ελαττώνεται στο 32-55%, επειδή η μετεγχειρητική φλεγμονή μιμείται την παρουσία της νεοπλασματικής διήθησης. Συμπερασματικά θα λέγαμε ότι η μαγνητική και αξονική τομογραφία δεν είναι αρκετά ακριβείς για τη σταδιοποίηση του αρχικού όγκου (ειδικά μετά τη διουρηθρική), αλλά χρησιμοποιούνται για την εξακρίβωση της παρουσίας μεταστάσεων.
Επεμβατικές μέθοδοι:
– η κυστεοσκόπηση και η λήψη βιοψιών,
– η διουρηθρική εκτομή του όγκου
- Κυστεοσκόπηση

Η κυστεοσκόπηση (με άκαμπτο ή εύκαμπτο κυστεοσκόπιο), είναι η εξέταση εκλογής που θα θέσει την τελική διάγνωση σε συνδυασμό με τη βιοψία που λαμβάνεται. Με τη λήψη βιοψιών τόσο από τον όγκο, όσο και από τις γύρω από αυτόν περιοχές, επιτυγχάνεται η διάγνωση του ιστολογικού τύπου και βαθμού διαφοροποίησης του όγκου, καθώς και ο έλεγχος για την πιθανότητα συνύπαρξης άλλων (προ)καρκινικών βλαβών (CIS).

Η κυστεοσκόπηση δίνει τη δυνατότητα να εξετασθούν πολλοί από τους χαρακτήρες των όγκων, όπως η μακροσκοπική τους εικόνα (μισχωτή, άμισχη, οζώδης), το μέγεθος, ο αριθμός, η θέση, η συνύπαρξη φλεγμονής και επιτρέπει παράλληλα την εκτίμηση των ουρητηρικών στομίων.
Διουρηθρική εκτομή του όγκου
Η διουρηθρική εκτομή του όγκου (TURT: transurethral resection of the tumor) της κύστης και στη συνέχεια η ιστολογική εξέταση του παρασκευάσματος καθορίζει τελικά τον ιστολογικό βαθμό και στάδιο Τ του όγκου, ενώ παράλληλα οι τυχαίες βιοψίες προσδιορίζουν το διάχυτο ή μη της νεοπλασματικής βλάβης. Τονίζεται ότι το ενδεχόμενο υπολειμματικού όγκου μετά την διουρηθρική παραμένει υψηλό. Μελέτη αναφέρει πως υπολειμματικός καρκίνος ανευρέθη σε ποσοστό 33% στην επαναληπτική διουρηθρική.

Επίσης, ο κυστεοσκοπικός φθορισμός μπορεί να βοηθήσει στην αναγνώριση των όγκων της κύστης, που δεν αναγνωρίζονται με πηγές λευκού φωτός.
Συνήθως, μια λάμπα ξένου χρησιμοποιείται για να εντοπίσει το φθορισμό του επαγωγικού φωτός της φωτοευαίσθητης πρωτοπορφυρίνης ΙΧ, που προκαλείται μετά από τοπική εφαρμογή 5-αμινολεβουλινικού οξέος. Η ευαισθησία αυτής της μεθόδου μπορεί να φθάσει το 96%.
Η σειρά που ακολουθείται συνήθως για την διάγνωση του καρκίνου της κύστης είναι: λήψη του ιστορικού, κλινική εξέταση, υπερηχογράφημα κύστης, κυστεοσκόπηση και λήψη βιοψιών, αξονική ή μαγνητική τομογραφία αν καρκίνος διηθητικός.
Από την στιγμή που θα τεθεί ιστολογικά η διάγνωση ‘καρκίνος ουροδόχου κύστης’ το επόμενο βήμα είναι η παθολογοανατομική και κλινική σταδιοποίηση της νόσου. Τα συστήματα παθολογοανατομικής και κλινικής σταδιοποίησης που κυρίως εφαρμόζονται σήμερα είναι το σύστημα Marchall (1952) (το οποίο αποτελεί τροποποίηση του συστήματος των Jewett και Strong (1946)) και το σύστημα TNM (Tumour, Nodes, Metastasis) που έχει προταθεί (1974) από την Διεθνή Ένωση εναντίον του καρκίνου (International Union Against Cancer, UICC), τροποποιήθηκε το 1989 και επαναδιατυπώθηκε το 1997.
ΤΑΞΙΝΟΜΗΣΗ ΚΑΡΚΙΝΟΥ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ ΜΕ ΔΙΑΦΟΡΕΤΙΚΟ ΘΕΡΑΠΕΥΤΙΚΟ ΚΑΙ ΠΡΟΓΝΩΣΤΙΚΟ ΕΝΔΙΑΦΕΡΟΝ
ΕΠΙΦΑΝΕΙΑΚΟΙ ΟΓΚΟΙ (Τα λεγόμενα θηλώματα):
- pTa βλάβη μόνο στο πρώτο στρώμα, που λέγεται βλεννογόνος
- pT1 βλάβη και στο 2ο στρώμα που λέγεται χόριο (περιλαμβάνει και την υποβλεννογόνια μυϊκή στιβάδα)
Σε αυτές τις 2 κατηγορίες θηλωμάτων παίζει ρόλο και ο βαθμός επιθετικότητας των κυττάρων (χαμηλός ή υψηλός βαθμός κακοήθειας)

Mέχρι σήμερα, το 2022, κανένας παράγοντας (βιταμίνες ή άλλα στοιχεία) δεν μπορεί να προταθεί ως προστατευτικός για την αποφυγή του καρκίνου της ουροδόχου κύστης με αποτέλεσμα να μην έχει ακόμη καθοριστεί η στρατηγική της πρόληψής του πέρα από την αποφυγή του καπνίσματος. Για τη θεραπεία των επιφανειακών όγκων της ουροδόχου κύστης απαιτείται ολοκληρωτική αφαίρεση του όγκου και εκτίμηση για περαιτέρω συμπληρωματική θεραπεία και παρακολούθηση του ασθενούς. Θεραπεία εκλογής είναι η διουρηθρική αφαίρεση TURT με ρεζεκτοσκόπια που διαθέτουν ηλεκτρική αγκύλη κοπής και επικρατέστερα με διπολικό ρεύμα turis, ή λιγότερο συχνά με laser (Nd: YAG, Holmium: YAG, CO2, KTP) που προκαλούν θερμική τήξη και εξάχνωση (Herr και συν, 2001). Τα laser έχουν ως πλεονέκτημα τα χαμηλά ποσοστά επιπλοκών (π.χ., αιμορραγία, διάτρηση, ερεθιστικά συμπτώματα), ενώ βασικό μειονέκτημα είναι η αδυναμία συλλογής υλικού για βιοψία. Η TURT πραγματοποιείται υπό συνεχή ενδοκυστική ροή διαλυμάτων (αποστειρωμένου νερού ή αμινοξέων) και απαιτείται στο υλικό βιοψίας να περιέχονται και μυϊκές ίνες για τον καθορισμό του σταδίου του όγκου. Έτσι, η TURT αποτελεί τη θεραπεία εκλογής αλλά και σταδιοποίησης της νόσου. Πιθανές επιπλοκές της TURT είναι η αιμορραγία, η διάτρηση της κύστης, η κυστεοουρητηρική παλινδρόμηση και τα στενώματα της ουρήθρας (πολύ μικρά ποσοστά σε έμπειρα χέρια).
Πολλοί ασθενείς υποβάλλονται σε επανάληψη της TURT λόγω υποτροπής του καρκίνου της κύστης. Οι ασθενείς που παραμένουν χωρίς υποτροπή κατά τη διάρκεια του πρώτου έτους παρακολούθησης, είναι πιθανό να μην υποτροπιάσουν για μερικά χρόνια, ενώ εκείνοι που παρουσιάζουν υποτροπή κατά το πρώτο έτος (που είναι και οι περισσότεροι) έχουν υψηλό κίνδυνο να υποτροπιάσουν στο μέλλον. Υποστηρίζεται ότι το 50% των όγκων σταδίου Τα και το 70% των όγκων σταδίου Τ1 υποτροπιάζουν στα 3 χρόνια μετά την TURT.
Η υψηλή συχνότητα των υποτροπών αποδίδεται πρωταρχικά στον πολυεστιακό χαρακτήρα της νόσου, αν και η εμφύτευση καρκινικών κυττάρων κατά την TURT θεωρείται ως ένας επιπρόσθετος προδιαθεσικός παράγοντας. Υποστηρίζεται ότι οι περισσότερες υποτροπές αποτελούν νέους όγκους προερχόμενους από δυσπλαστικές βλάβες, η από μη ορατές ενδοσκοπικά νεοπλασίες. Επίσης, μία σημαντική αιτία υποτροπής είναι η μη πλήρης εκτομή του όγκου στην πρώτη TURT. Η υποτροπή στους 3 μήνες οφείλεται κυρίως σε ανεπαρκή TURT ή/και σε εμφύτευση καρκινικών κυττάρων σε τραυματισμένα σημεία ή/και σε ταχεία καρκινική ανάπτυξη, γι’ αυτό σε υψηλού βαθμού κακοήθειας όγκους συνίσταται και 2η TURT εντός τριών βδομάδων από την 1η TURT. Πρόσφατα, διαπιστώθηκε ότι η πραγματοποίηση μιας δεύτερης TURT, 4-6 εβδομάδες μετά την πρώτη, ανέδειξε υπολειπόμενο όγκο στο 20% των ασθενών, που ήταν υψηλότερου ιστολογικού βαθμού σε ποσοστό 8,2%, ενώ άλλες μελέτες ανεβάζουν το ποσοστό υποτροπής στο 38%, ακόμα και μέχρι 80%. Επιπλέον, στο 75% των όγκων Τα και στο 85% των όγκων Τ1, η υποτροπή εντοπίστηκε στην περιοχή του όγκου που εξαιρέθηκε.
Θεραπεία των θηλωμάτων
Απόλυτη και αυστηρή πλήρης διουρηθρική (μέσα από την ουρήθρα) αφαίρεση.
Άμεση το 1ο 24ωρο έγχυση ενός κυτταροστατικού φαρμάκου στην κύστη (συνηθέστερη η επιρουμπικίνη)
Ανάλογα με το αν είναι pTa ή pT1 και επίσης ανάλογα με το αν πρόκειται για χαμηλού ή υψηλού βαθμού κακοήθειας όγκους, προτείνεται σχήμα ενδοκυστικών εγχύσεων με κυτταροστατικά φάρμακα ή το BCG (εξασθενημένο μυκοβακτηρίδιο της φυματίωσης).
Παρακολούθηση των ασθενών με θηλώματα
Η παρακολούθηση των ασθενών με επιφανειακούς όγκους της κύστης πρέπει να γίνεται σ’ όλη τη διάρκεια της ζωής τους, με κυστεοσκόπηση και κυτταρολογική εξέταση. Πρόσφατη βιβλιογραφική ανασκόπηση αναφέρει ότι οι προαναφερόμενες εξετάσεις στα ούρα έχουν ειδικότητα 73-90%, ευαισθησία 49-77% και η χρήση τους για την παρακολούθηση μπορεί να αυξήσει τα μεσοδιαστήματα των κυστεοσκοπήσεων ελέγχου. Η συχνότητα της παρακολούθησης δεν είναι απαραίτητο να είναι ίδια σε όλους τους ασθενείς, αλλά πρέπει να πραγματοποιείται ανά τακτά χρονικά διαστήματα και να εξατομικεύεται, συσχετιζόμενη με τους προγνωστικούς παράγοντες.
ΔΙΗΘΗΤΙΚΟΣ ΚΑΡΚΙΝΟΣ ΟΥΡΟΔΟΧΟΥ ΚΥΣΤΗΣ

Αν στην αρχική διουρηθρική αφαίρεση του όγκου κύστης η ιστολογική διάγνωση αναδείξει διηθητικό καρκίνωμα (διήθηση μυός της κύστης), η αντιμετώπιση είναι διαφορετική, πιο επιθετική και η πρόγνωση πιο πτωχή.

Η κλασική θεραπεία για τον τοπικά περιορισμένο διηθητικό καρκίνο της ουροδόχου κύστης αποτελεί η ριζική κυστεκτομή και ο πυελικός λεμφαδενικός καθαρισμός. Αυτή η θεραπευτική προσέγγιση απαλάσσει συχνά τον ασθενή από τη νόσο, όταν αυτή περιορίζεται μέσα στο όργανο και δεν υπάρχει επινέμηση των λεμφαδένων. Στον άνδρα η κύστη αφαιρείται μαζί με τον προστάτη και στη γυναίκα συνήθως μαζί με τη μήτρα και ωοθήκες. Και στα 2 φύλα περιλαμβάνεται και η εκτεταμένη ταυτόχρονη εξαίρεση των λεμφαδένων της πυέλου (λεκάνης). Αποτελέσματά από 1054 ασθενείς με ριζική κυστεκτομή ανέφεραν ποσοστά δεκαετούς ελεύθερης νόσου και συνολικής επιβίωσης 66% και 43% για όλους τους ασθενείς, αντίστοιχα. Η επίπτωση υποτροπών της νόσου σχετίζεται με το φύλο, το παθολογοανατομικό στάδιο, τη λεμφαδενική μετάσταση, τη λεμφαδενική διήθηση, όπως και την αγγειακή διήθηση. Η παρουσία θετικών λεμφαδένων αποδείχτηκε ένας ιδιαίτερα πτωχός προγνωστικός παράγοντας, με ποσοστά δεκαετούς ελεύθερης νόσου επιβίωσης 75% για όλους τους ασθενείς με αρνητικούς λεμφαδένες σε σύγκριση με μόλις 34% σε ασθενείς με λεμφαδενική διασπορά. Σημαντικό να αναφερθεί πως πριν την κυστεκτομή απαράιτητα θα πρέπει να λάβουν χώρα 2-3 κύκλοι χημειοθεραπείας, ώστε να επιτευχθεί συρρίκνωση του όγκου, κάτι που βελτιώνει την πρόγνωση μετά το χειρουργείο.
Η επιβίωση μετά την κυστεκτομή έχει συσχετιστεί με τον αριθμό των εξεταζόμενων λεμφαδένων, όπως επίσης και με τον αριθμό των θετικών λεμφαδένων, υποθέτοντας ότι η ποιότητα και η έκταση της λεμφαδενεκτομής είναι υψηλού ενδιαφέροντος και έχει επίπτωση στο θεραπευτικό αποτέλεσμα. Αυτή η άποψη οδήγησε στην ιδέα της λεμφαδενικής πυκνότητας, ή της αναλογίας (ratio) (αριθμός θετικών λεμφαδένων προς τον ολικό αριθμό των αφαιρεθέντων λεμφαδένων). Πρόσφατες μελέτες έδειξαν ότι η επιβίωση βελτιώνεται σημαντικά όταν λιγότεροι από 20% των λεμφαδένων είναι θετικοί. Το συμπέρασμα αυτό μπορεί να αποδειχθεί χρήσιμο στην περαιτέρω εντόπιση ασθενών με υψηλό κίνδυνο για υποτροπή. Η ανάγκη για εκτεταμένη λεμφαδενεκτομή στον καρκίνο της ουροδόχου κύστης είναι επιτακτική και προφανής.
Είναι αλήθεια πως ογκολογικά η ανοικτή κυστεκτομή έχει τα ίδια καλά αποτελέσματα με τη ρομποτική. Η τελευταία όμως λόγω της ελάχιστης παρέμβασης υπερτερεί στην απώλεια αίματος, στη μείωση του εγχειρητικού τραύματος, στην κατάχρηση των αναλγητικών, στην κινητοποίηση των ασθενών και έξοδο από το νοσοκομείο, όπως και στην πιθανότητα μετεγχειρητικών κηλών λόγω έλλειψης τομής. Επίσης, η ρομποτική με περίσσεια ακρίβειας και πολύ πιο περιορισμένων χειρισμών αποκαθιστά την εκτροπή των ούρων με δημιουργία νέας κύστης από έντερο.

Εδώ και πολλά χρόνια στο Κέντρο Ελάχιστα Επεμβατικής Ουρολογίας, έχουν πραγματοποιηθεί πληθώρα ρομποτικών ριζικών κυστεκτομών με εκτροπή ούρων με εξαιρετικά και ογκολογικά αλλά και λειτουργικά αποτελέσματα (εγκράτεια και ακόμα διατήρηση στυτικής λειτουργίας στους άνδρες). Επειδή θεωρείται δε κέντρο αναφοράς, έχουν πραγματοποιηθεί και κυστεκτομές διάσωσης μετά από αποτυχημένη ακτινοθεραπεία, εξαιρετικά δύσκολη επέμβαση λόγω των ινώσεων που προκαλεί η ακτινοβολία.
Αν ο ασθενής δεν είναι υποψήφιος για ριζική κυστεκτομή λόγω άλλης νοσηρότητας ή προχωρημένης ηλικίας, τότε ακολουθείται συνδυασμός ακτινοθεραπείας μαζί με χημειοθεραπεία, αλλά με πτωχότερα αποτελέσματα αναφορικά στην πρόγνωση.
Ο ρόλος του Ουρολόγου
Ο ουρολόγος διαδραματίζει καθοριστικό ρόλο στην υγεία τόσο του άνδρα όσο και της γυναίκας, αντιμετωπίζοντας παθήσεις του ουροποιητικού και του αναπαραγωγικού συστήματος. Ειδικεύεται στη διάγνωση και θεραπεία προβλημάτων όπως οι καρκίνοι, οι ουρολοιμώξεις, οι λίθοι, η ακράτεια και οι σεξουαλικές δυσλειτουργίες. Με τη γνώση και την εξειδίκευσή του στη ρομποτική χειρουργική, προσφέρει ελάχιστα επεμβατικές λύσεις με μεγαλύτερη ακρίβεια και ταχύτερη ανάρρωση για τους ασθενείς.